
3D bioprinting och stamceller inom plastikkirurgi
Kort beskrivning
Stamceller finns i alla kroppens organ och i flera varianter och har som funktion att säkerställa att en viss vävnadstyp kan ersättas kontinuerligt under livet och att bidra till läkning av en skada på vävnaden i fråga.
En grundläggande egenskap för stamceller är att de kan stimuleras till att utvecklas till flera olika vävnadtyper. Därigenom blir det möjligt att få fram vävnader, t ex brosk eller hud som används på en plastikkirurgisk klinik.
All regenerativ medicin behöver ha en källa för att få fram material och vi har utrustning som kan extrahera stora mängder patientspecifika fettstamceller ur fett från fettsugning. Vi har stimulerat dessa stamceller att omvandlas till brosk. Sammantaget har vi således en närmast outsinlig källa för patientspecifika stamceller som kan användas för att skapa patientspecifika vävnader.
Övergripande bakgrund och målsättning
Stamceller finns i alla kroppens organ och i flera varianter och har som funktion att säkerställa att en viss vävnadstyp kan ersättas kontinuerligt under livet och att bidra till läkning av en skada på vävnaden i fråga.
Den största och mest lättillgängliga källan för stamceller är fettväven. Där finns fettstamceller, adipocytära stamceller, som kan fås att bilda flera olika vävnadstyper, t ex brosk. På en plastikkirurgisk klinik finns god tillgång på fettväv, t ex efter fettsugning, och därmed är fettväv en lättillgänglig källa för att utvinna stamceller.
En grundläggande egenskap för stamceller är att de kan stimuleras till att utvecklas till flera olika vävnadtyper.
Stamceller kan endera själva utvecklas till en viss celltyp eller utöva sin verkan genom att stimulera andra, specifika, celler till tillväxt. Detta är en grundläggande princip som bidrar till att få fram ny vävnad. Därigenom blir det möjligt att få fram vävnader, t ex brosk eller hud som används på en plastikkirurgisk klinik. Den övergripande tanken härvidlag är att ta fram stamceller ur patientens egen fettväv.
All regenerativ medicin behöver ha en källa för att få fram material och sedan föregående ansökan har vi införskaffat utrustning och kan framgångsrikt extrahera stora mängder patientspecifika fettstamceller. Vi har stimulerat dessa stamceller att omvandlas till brosk. Sammantaget har vi således en närmast outsinlig källa för patientspecifika stamceller som kan användas för att skapa patientspecifika vävnader, liksom för att påverka immunreaktioner.
Bakgrund
Ett övergripande problem vid all rekonstruktiv plastikkirurgi är bristen på vävnad. Traditionella tekniker inkluderar metoder såsom att ta brosk från t ex revbensbågar för att använda till rekonstruktion av öron, expandera hud mekaniskt och transplantera hud från en kroppsyta till en annan osv.
Ny teknik gör att odlad vävnad kan komma att bli ett alternativ för att råda bot på bristen på lämplig vävnad.
Ytterligare en utveckling för att skapa vävnad är 3D bioprinting där man med 3D skrivare, laddad med biobläck och levande celler, skriver ut den vävnad man behöver. Den tekniska utvecklingen har kommit långt med biobläck som har väldigt speciella egenskaper. Bläcken är skjuvförtunnande vilket innebär att de i vila är relativt fasta samtidigt som de blir flytande när de utsätts för trycket i skrivarnålen. Bläcken utgör en miljö där celler trivs och växer till. Bläckens komponenter kan göras resorberbara eller icke resorberbara beroende på vad man vill åstadkomma. De bästa skrivarnas maximala upplösning är i storleksordningen 10 mikrometer dvs i princip en celldiameter.
Helt analogt med att vävnader är en bristvara så är de specifika celler (t ex broskceller) som blandas i bläcken en bristvara. Den etablerade metoden för att avhjälpa detta är att blanda specifika celler med stamceller. Stamcellerna kan endera själva utvecklas till den önskade celltypen eller stimulera de tillsatta specifika cellerna till tillväxt.
Sedan ett antal år finns ett samarbete etablerat mellan Avdelningen för plastikkirurgi vid Göteborgs universitet och Chalmers, BBV. Vi har genomfört serier av experiment där vi 3D bioprintat brosk och hud. Vi har använt stamceller i kombination med broskceller och visat att stamcellerna ger ökad tillväxt av broskceller. Tidigare har vi fått förlita oss på köpta, odlade stamceller endera från benmärg eller fett. Dessa kommersiella stamceller är förstås inte individspecifika, de är svåra att odla och tillgången kan vara en begränsande faktor. Kvaliteten på stamcellerna är svår att kontrollera. Numera, med egen möjlighet att ta fram stamceller ur fett skapas förutsättningar för närmast obegränsad tillgång på fettstamceller. Forskargruppens övergripande mål är att skapa vävnad som är specifik för en given patient, dvs om den 3D bioprintade vävnaden är av tillräckligt god kvalitet får vi inte några immunologiska problem med avstötning när vävnaden används på patienten.
3D bioprintat brosk
Brosk förekommer i tre olika former:
- Hyalint brosk i viktbärande leder, innehåller ca 80% vatten, relativt få broskceller (chondrocyter) och tunna fibriller av kollagen typ 2.
- Fibröst brosk i mellankotskivorna, innehåller tjockare fibriller av kollagen typ 2.
- Elastiskt brosk i ytteröron, relativt hög täthet av chondrocyter, innehåller fibrer av proteinet elastin.
Brosk saknar blodkärl och nerver och har mycket begränsad förmåga till läkning. Skadas brosket så blir det förlust av form och funktion.
För rekonstruktion av ytteröra används idag en teknik där man tar revbensbrosk som skulpteras till formen av ett ytteröra och sätts på plats under huden på skallens sida. Med flera konsekutiva operationer får man till slut fram ett ytteröra. Hela processen karaktäriseras av att den kräver många timmars operation, den innebär avsevärd smärta på tagstället och att resultaten är ofta suboptimala.
3D bioprinting av brosk innebär att man kan skriva ut brosk i önskad form med hög upplösning. I förlängningen är målet att kunna skriva ut ett ytteröra som förses med hudtäckning och transplanteras. Vinsten är tänkt att bli ett mycket naturtroget öra uppbyggd med patientens egna celler samtidigt som patienten slipper den smärtsamma och långdragna operationsprocessen.
Arbetsplan
3D bioprintade konstrukt printas med ett bioink uppbyggt av nanocellulosa. Konstrukten innehåller enbart broskceller eller en kombination av humana broskceller och humana stamceller. Stamcellerna kommer från benmärg eller fett. Konstrukten implanteras i naken mus och tas ut efter 30 respektive 60 dagar. Långtidsförsök där vi låtit konstrukten sitta så länge som djurets livslängd tillåter, visar att konstrukten inte omvandlas till ben eller att broskcellerna tillväxer okontrollerat.
Konstrukten analyseras i mikroskop vad gäller morfologi.
FISH-analys använd för att bestämma ursprunget av de celler man ser. Glykosaminoglykaner påvisas med Alcian blue och Saffranin-O. Kollagen typ 2 påvisas immunhistokemiskt.
Broskcellernas tillväxt analyseras genom att räkna samtliga kärnförande celler som samtidigt har cytoplasma med innehåll av glykosaminoglykan.
Preliminära resultat
Broskcellerna överlever printingprocessen och tillväxer in konstruktet in vivo. Tillägg av stamceller från benmärg gör att celltillväxten ökar men stamcellerna själva omvandlas inte till broskceller. Istället är verkningsmekanismen att de stimulerar de broskceller som ingår i printingprocessen. Konstrukten bibehåller utmärka mekaniska egenskaper efter 30 respektive 60 dagar in vivo. Mätningar av mekaniska egenskaper efter 10 månader in vivo visar att konstrukt som innehåller broskceller är mekaniskt överlägsna konstrukt utan celler. Makroskopiskt påminner konstrukten om brosk och är vita, blanka, hållfasta och lätta att hantera.
Broskcellerna producerar glykosaminoglykaner och kollagen typ 2, dvs det de förväntas att göra.
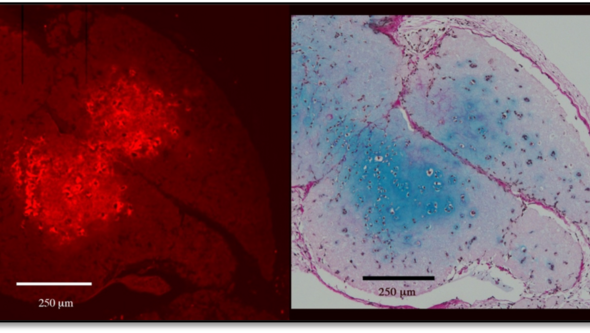
Bildtext: Ovan ser man till vänster röd infärgning för kollagen typ 2 och till höger blå färgning för glykosaminoglykaner. Snitten är konsekutiva. Notera hur färgningen för respektive ämne är som intensivast över precis samma område, vilket indikerar att det är just broskcellerna som producerar båda ämnena.
FISH visar att det är broskcellerna som prolifererat medan stamcellerna försvunnit.
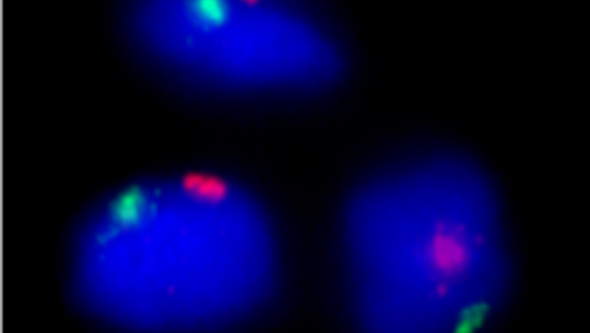
Bildtext: Ovan till vänster, ser man hur cellerna är positiva för både human kromosom X och Y, dvs det är de manliga cellerna från broskdonator som vuxit till. De kvinnliga stamcellerna syns inte till.
Hud som transplanteras till en 3D bioprintad broskbit växer fast och läker in kant i kant med djurets egen hud. De printade bitarna har således förutsättningar att ingå som underlag i en mer komplex konstruktion.
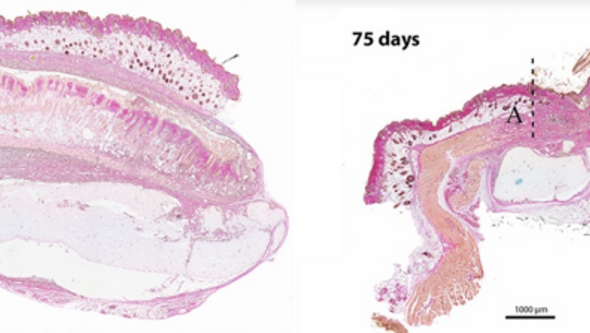
Bildtext: Ovan ser man till vänster ett fullhudstransplantat som vuxit fast mot underlaget av 3D bioprintat brosk. Djurets egen hud ligger som ett skyddande lager över brosk/hud konstruktionen Till höger ser man hur man sytt djurets egen hud kant i kant med det hudtransplantat som sitter på den 3D bioprintade broskbiten. Skarven mellan djurets egen hud och transplantatet finns vid A. B är det 3D bioprintade brosket och C är hudtransplantatet.
Nästa steg
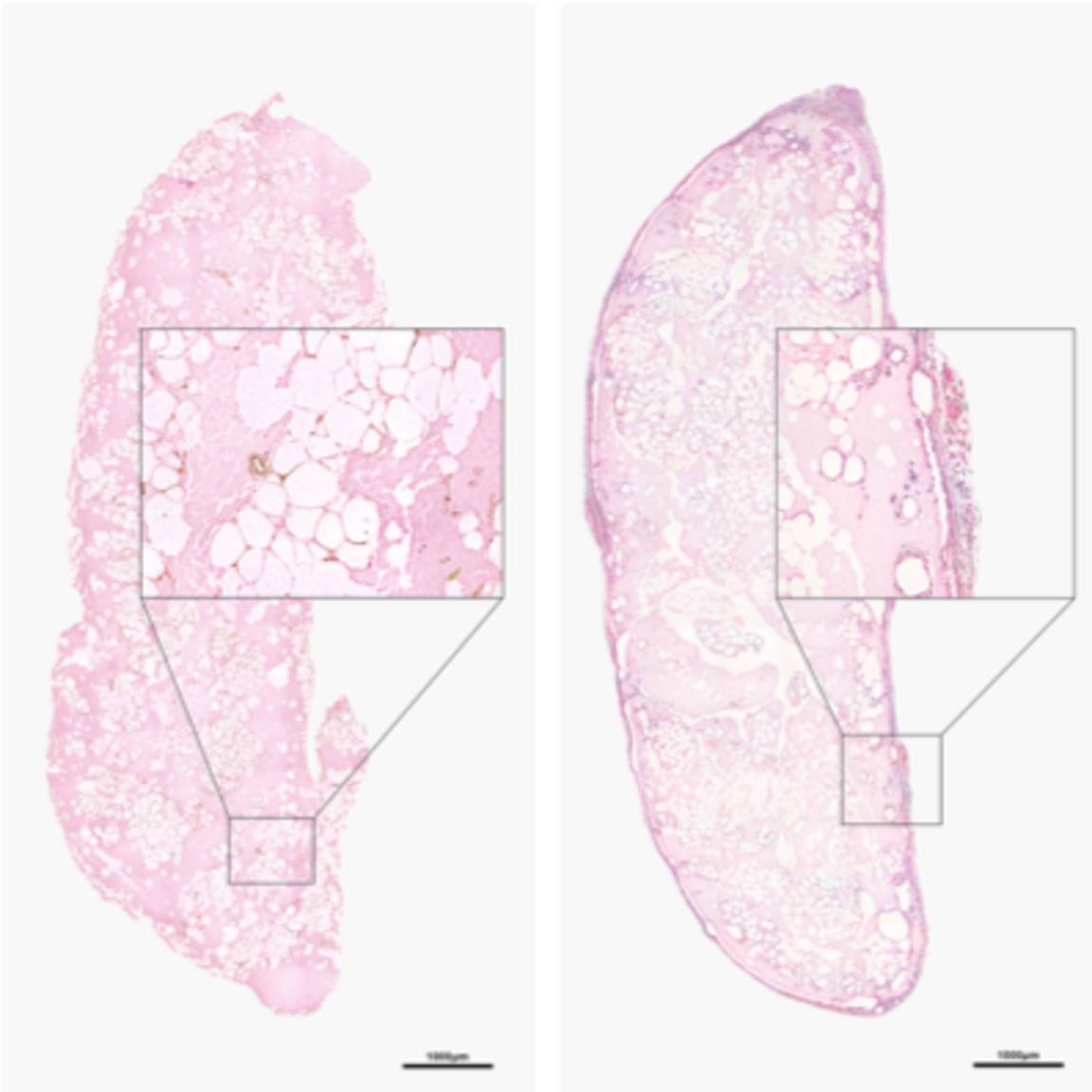
Nästa steg i serien av experiment går ut på att byta källa för stamcellerna. Tidigare har vi använt stamceller från benmärg men de är svåra att få tag på och måste köpas och sedan odlas upp för att få tillräckligt antal. Tack vare de medel vi erhöll från IngaBritt och Arne Lundbergs Forskningsstiftelse 2018 införskaffades apparatur som gör att vi kan extrahera fettstamceller ur fettvävnad som vi får vid fettsugning av plastikkirurgiska patienter. Förutom stamceller, får vi även kärlceller (endotel) och sk. progenitorceller som bygger upp blodkärlens väggar. Om man väljer att inte sortera ut de olika fraktionerna så kallas blandningen av celler för Stromal Vascular Fraction (SVF). Det finns rikligt med stamceller i preparationerna. Cellerna sorteras och räknas i flödescytometer med hjälp av kombinationer av antikroppar som fäster till de olika celltyperna.

Bildtext: Ovan visar resultatet av våra egna flödescytometriska analyser av cellinnehållet i stromal vascular fraction (SVF) preparerat med Cytori. Viabilitetstest med 7-AAD exklusionsmetod påvisar ca 97% levande celler och av dessa utgörs ca 3% av adipocytära stamceller (ASC) av fenotyp CD73+ CD90+CD31-CD45- (gröna molnet).
Vi har stimulerat dessa stamceller till att omvandlas till brosk. Sammantaget gör detta att nu har vi en närmast outsinlig källa till stamceller som i sin tur kan bilda olika vävnader. Dessa celler är specifika för den patient från vilken fettet kommer och det betyder att vi kan generera specifika celler och vävnader från praktiskt taget alla patienter, eftersom alla har fettväv som kan användas
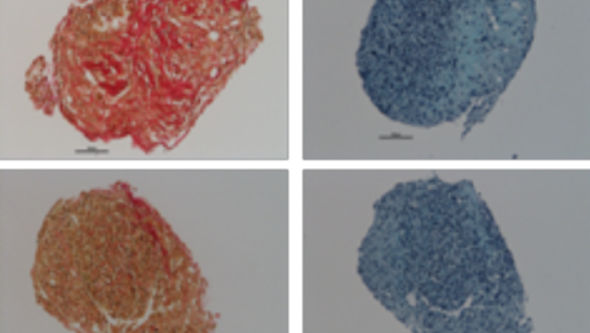
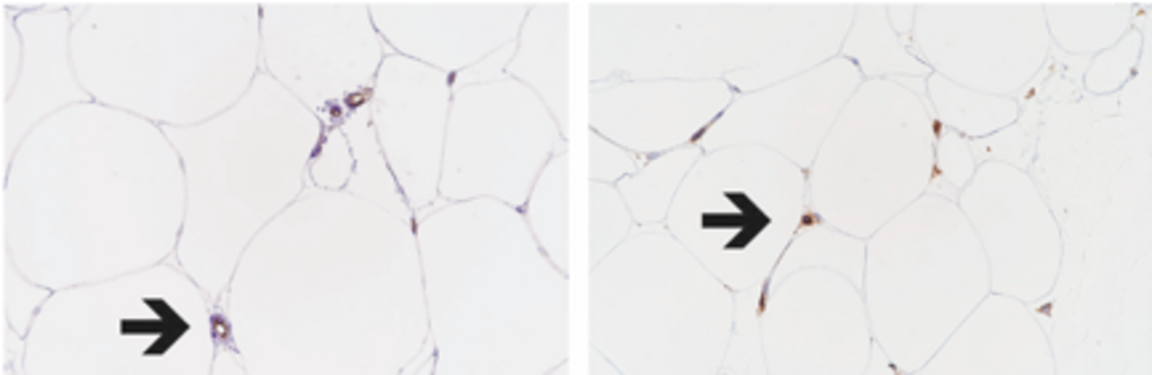
Bildtext: Differentiering av ASC (upptill) samt SVF (nedtill) från samma givare. Infärgning med Safranin O (rött) och Alcian Blue (Blått) påvisar broskdifferentiering efter ca 3 veckors in vitro-stimulering i pelletformation. Man ser att det blir mycket snarlikt resultat oberoende av om man utgår direkt från SVF eller sorterar ut ASC först. Resultatet innebär att vi kan skapa brosk från fett, specifikt för varje patient.
Endera kan cellerna ingå direkt i printingprocessen eller så kan de odlas upp så att stora mängder celler erhålls. Givetvis är det enklaste att printa direkt med SVF som är en blandning av alla celltyper.
Förutom fördelen med god tillgång löser SVF ett annat problem så till vida att reglementet kring odling av celler som är tänkta att återföras till patient är rigoröst. Visserligen kvarstår det faktum att den tänkta metoden innebär att vävnaden och cellerna utsätts för enzymatisk behandling men metoden är ändå betydligt mer direkt applicerbar jämfört med om man dessutom måste odla stamcellerna först.
Blodkärl i 3D bioprintade konstrukt
Den enskilt största begränsningen för hur stora konstrukt man ska kunna printa är transporten av syre och näringsämnen till cellerna i den printade vävnaden. Utan blodkärl så blir maximal tjocklek ca 0,5 mm, dvs dubbla diffusionsavståndet.
Arbetsplan och preliminära resultat
Metod 1:
Vi har printat med mikrofrakturerat fett blandat i biobläcket. Fettet består av minimala bitar, flisor, av fett från fettsugning som bara bearbetats mekaniskt. Det gör att alla fettets komponenter ingår dvs cellerna, t ex stamceller, sitter i sin rätta miljö. Vidare ingår flisor av blodkärl med sina celler. I ett pilotprojekt printade vi 3 mm tjocka bitar och implanterade i nakna möss. Efter 30 och 60 dagar visade det sig att bitarna levde och cellerna mådde utmärkt trots att det var betydligt tjockare än vad som skulle vara möjligt. Vi kunde se blodkärl både i kanterna och mitt inuti bitarna och inuti blodkärlen fanns röda blodkroppar. Helt plötsligt hade vi således skapat fungerande blodkärl i ett 3D bioprintat konstrukt. Detta är ett avgörande genombrott som gör att vi kan jobba vidare med tjockare konstrukt och låta kärl från mikrofrakturerat fett vara en del av konstruktionen. Ovan har vi en bild som visar hur hud kan fästa på ett printat brosk och man kan tänka sig att förfina detta genom att printa brosk centralt, omgivet av fett och sedan lägga hud utanpå det, dvs då har vi verkligen alla de lager som behövs för ett ytteröra; brosk, underhudsfett och hud.
Metod 2:
Ett annat sätt att skapa kärlförsörjning i 3D bioprintade konstrukt är att printa sin vävnad porös, som ett tredimensionellt nät. Då skulle kanalerna i vävnaden göra att avståndet in till cellerna minskar, jämfört med om konstruktet är solitt. Hittills har detta resonemang varit till stora delar teorier men vi har lyckats visa att det i nätets porer kan växa in vävnad från mottagaren och att det i denna vävnad finns blodkärl som fungerar. Vi har mikroskopiska studier, och nu också cirkulationsstudier med magnetkamera, som visar att blodkärlen fungerar. Detta gör att syreförsörjningen till mitten av ett konstrukt kan säkras med formen på konstruktet i sig.
Metod 3:
Ett tredje sätt att påverka kärlbildningen har vi alldeles nyss börjat jobba med. Eftersom vi kan sortera ut t ex kärlceller (endotel) från fettväv så vill vi försöka att mer direkt skapa själva kärlen. Sedan tidigare är det känt att man kan få t ex endotelceller att fastna på ytor som förbehandlats genom att täcka ytan med proteiner, t ex proteinet fibronectin. Vi har nu fått endotelceller från navelsträngsblod (HUVEC) att fastna på ytor av vårt biobläck (nanocelleulosa) som förbehandlats med fibronectin och andra proteiner. I nästa steg, som pågår just nu, har vi fått endotelceller från vår egen cellkälla, fettet, att fästa. Likaså fäster cellblandningen i SVF alldeles utmärkt. Detta gör att vi har verktyg att försöka så ut celler i kanaler i konstrukten och därigenom skapa blodkärl.
Nästa steg
Sammanfattningsvis har vi således flera olika verktyg för att försöka skapa kärlförsörjning i konstrukten; att printa i tredimensionell nätstruktur, att använda mikrofrakturerat fett där kärlen bildas spontat av de ingående fragmenten av blodkärl och att med endotelceller försöka skapa kärl. Man kan tänka sig att kombinera metoderna på olika sätt men allt går ut på att skapa cirkulation i de printade vävnaderna så att storleken inte begränsas av diffusionsavståndet.
3D bioprintad hud
Huden är vårt största organ och några av dess viktigaste funktioner är att skydda kroppen från omgivningen och att förhindra vätskeförlust. En skada i huden som inte läks snabbt nog kan få stora konsekvenser för patienten och resultera i dödsfall. Ca 11 miljoner människor runt om i världen drabbas varje år av brännskador allvarliga nog för att kräva sjukhusvård (WHO). Graden (djupet) av brännskadan spelar en stor roll på hudens kapacitet till läkning. Brännskador av en högre grad leder till en icke-fungerande eller obefintlig sårläkning och här måste patienten snabbt få hjälp för att förhindra vätskeförlust och infektioner som i värsta fall kan leda till döden. Brännskador behandlas bland annat genom transplantat av patientens egna hud. När brännskadorna täcker stora delar av kroppen är det inte möjligt att använda patientens egen friska hud som behandling och det är här nya behandlingsmetoder krävs för att underlätta läkningen för patienten. Vårt projekt syftar till att med hjälp av 3D-bioprintingteknik skriva ut ”hud” av patientens egna celler tillsammans med ett stödjande material. Dessa konstrukt transplanteras sedan till patienten där kroppen fungerar som den ultimata inkubatorn för att få optimal celltillväxt och nybildning av hud. Innovationen med denna idé är att kunna designa patientegna transplantat (3D-bioprintade konstrukt) i kliniskt godkända material utan att använda stora ytor av patientens egna hud. Detta skulle innebära mindre smärta för patienten eftersom man skulle slippa att ta stora bitar hud men ändå få en förbättrad läkning i och med att transplantaten efterliknar fullständig hud.
Arbetsplan
För biobläckutveckling kommer fibrin och kollagen att användas som huvudsakliga ingredienser och blandas med celler eller mikroskopiska hudbitar. Utvärdering kommer att ske genom att titta på reologiska egenskaper, printbarhet och cytotoxicitet. 3D bioprintade hudkonstrukt kommer att odlas in vitro och användas i två djurmodeller, naken mus och gris där vi studerar hur den printade huden utvecklas och hur såren läker.
I in vitromodellerna kan vi utvärdera cellviabilitet, produktion av kollagen och andra hudspecifika markörer. Printad hud kommer också att placeras i sår som stansas i human hud som är överskottsvävnad från plastikkirurgiska operationer. I dessa skapade sår kan vävnadsregenerering studeras på ett reproducerbart sätt.
Till naken mus kan man transplantera 3D bioprintad vävnad som innehåller humana celler utan att vävnaden stöts bort.
Grisens sårläkning är mest lik människans. Huden på gris är uppbyggd på samma sätt som hos människa, läker på liknande sätt och dessutom är grisar immunspecifika individer, precis som människa.
Preliminära resultat
Printabilitet:
Bläckens printabilitet påverkas av mängden alginat och fibrin. Båda bioinken baserade på cellulosa visar bra printabilitet.
Kollagen är ett mer lättflytande material och en annan printingmetod behöver tillämpas. Denna metod kallas FRESH (freeform reversible embedding of suspended hydrogels) och innebär att man printar i en stödstruktur av gelatin. Gelatinet tas sedan bort samtidigt som man crosslinkar kollagenet och får sin 3D struktur.
Cellöverlevnad:
In vitroförsök med nanocellulosa ink och fibrin ink (nanocellulosa, alginat, fibrin) har genomförts. Fibroblaster har blandats med de olika bioinken och printats till hudkonstrukt. Dessa har transplanterats till en sårmodell av human hud och följts i upp till 28 dagar. Cellviabiliteten var hög genom hela försöket och fibrininket visade på sträckta fibroblaster redan vid dag 1. Utsträckta celler är ett tecken på att cellerna har bundit till ytan och antagit en mer vävnadslik morfologi. Keratinocyter seedades på konstrukten efter 14 dagar och tilläts sedan att differentiera i luft. Histologiska färgningarna gjordes för att undersöka cellernas morfologi och eventuell kollagenproduktion. Snitten visar på många celler vid ytan av konstrukten och viss kollagenproduktion fanns bland dessa celler. I mitten av konstrukten är dock cellerna av en rundare karaktär och ingen positiv färgning för kollagen kunde ses.
Transplantation till sårmodell:
För att utvärdera 3D-bioprinting som metod för att facilitera sårläkning användes en modell bestående av normal frisk human hud. Experimentella sår stansades i huden (3 mm diameter). Konstrukt bestående av olika typer av ink blandat med humana fibroblaster transplanterades till såren. Försök utfördes även med ett separat lager av keratinocyter ovanpå konstrukten. Sårmodellen följdes över tid för att studera läkningsprocessen och cellviabilitet i konstrukten. Resultaten pekar på att cellerna överlever processen och är viabla i de läkande såren. Inga problem identifierades vad gäller biokompatibilitet hos konstrukten.
In vivo:
För att studera den 3D-bioprintade huden i en mer komplex miljö har försök i djurmodell utförts. Den aktuella modellen är så kallad nakenmus, och har valts på grund av att normalt immunförsvar saknas. Detta medger transplantation av humana celler utan bortstötningsreaktion.
Konstrukt bestående av olika ink har 3D-bioprintats tillsammans med humana fibroblaster och keratinocyter placerades under huden på nakenmus. Efter 14 respektive 30 dagar har konstrukten plockats ut, fixerats och bäddats in i paraffin. Vävnadssnitt från de olika konstrukten har färgats med immunohistokemi för att detektera förekomsten av mogna keratinocyter, proliferativa celler och blodkärl. Viabla celler kunde identifieras i och runt konstrukten vid alla tidpunkter. Förekomst av blodkärl påvisades genom infärgning av proteinet von Willebrand Factor. Kärlinväxt är fundamentalt för långsiktig överlevnad av cellerna i konstrukten och dess vävnadintegration.
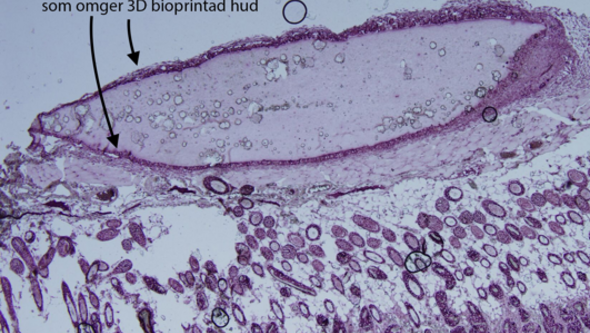
Nedan ser man en bit 3D bioprintad hud som suttit in vivo i 30 dagar. Runt kanterna finns CK14-positiva celler, dvs hudcellerna keratinocyter, som tycks trivas och prolifererar.
Nästa steg:
Som nästa steg i den sekvens av försök som planerats ska vi använda kollagenink, möjligen i kombination med fibrin för att ytterligare stimulera fibroblasterna till att växa till.
Vad gäller celler så är nästa steg att blanda in SVF med stamceller i hudprinten för att se om tillväxten av fibroblaster och keratinocyter blir bättre.
